Các công thức hóa học tập lớp 9 Đầy đầy đủ nhất
Chương 1. Những loại hợp chất vô cơ
Dạng câu hỏi CO2/SO2tác dụng với dung dịch kiềm
Oxit axit thường áp dụng là CO2và SO2. Dung dịch kiềm thường được sử udngj:
Nhóm 1: NaOH, KOH (kim các loại hóa trị I)
Nhóm 2: Ca(OH)2, Ba(OH)2 (kim loại hóa trị II)
Phương pháp giải
1. Việc CO2, SO2dẫn vào dung dịch NaOH, KOH
Khi mang lại CO2(hoặc SO2) tính năng với dung dịch NaOH đều xẩy ra 3 tài năng tạo muối:
CO2+ 2NaOH → Na2CO3+ H2O (1)
CO2 + NaOH → NaHCO3(2)
Đặt T = nNaOH/nCO2
Nếu T = 2: chỉ tạo nên muối Na2CO3
Nếu T ≤ 1: chỉ tạo thành muối NaHCO3
Nếu 1 3và Na2CO3
2. Việc CO2, SO2dẫn vào dung dịch Ca(OH)2, Ba(OH)2
Do ta ko biết sản phẩm thu được là muối hạt nào buộc phải phải tính tỉ lệ T:
Ca(OH)2+ CO2→ CaCO3↓ + H2O (1)
Ca(OH)2+ 2CO2→ Ca(HCO3)2(2)
Đặt T = nCO2: nCa(OH)2
Nếu T ≤ 1: chỉ chế tác muối CaCO3
Nếu T = 2: chỉ tạo ra muối Ca(HCO3)2
Nếu 1 3 và Ca(HCO3)2
Chương 2. Kim loại
1. Phương thức tăng sút khối lượngA+B2(SO4)n→ A2(SO4)m+ B
Trường vừa lòng 1: mA (tan)B (bám)
mB (bám)– mA (tan)= mkim nhiều loại tăng
Trường thích hợp 2: mA (tan)> mB (bám)
m A (tan) – m B (bám) = m kim loại giảm
⚗️ GIA SƯ HÓA
2. Bảo toàn khối lượng
∑mcác chất tham gia= ∑ mchất tạo ra thành
mthanh kim loại+ mdung dịch= m’thanh kim loại+ m’dung dịch
Phản ứng nhiệt nhôm:
nH2= nFe+ (3/2).nAl
nH2 = nFe + (3/2).nAl
Chương 3. Phi kim
Trong những phản ứng của C, CO, H2thì số mol CO= nCO2, nC= nCO2, nH2= nH2O.
Bạn đang xem: Những công thức hóa học lớp 9
mbình tăng= mhấp thụ
mdd tăng= mhấp thụ– mkết tủa
m dd giảm = m kết tủa – m hấp thụ
Chương 4. Hiđrocacbon
1. Lập công thức phân tử của hợp chất hữu cơBước 1: kiếm tìm phân tửu khối của hợp hóa học hữu cơ
Phân tử khối của hòa hợp chấy hữu cơ hoàn toàn có thể được tính theo những cách sau:
Dựa vào trọng lượng mol hợp chất hữu cơ: M = 12x + y + 16z (g/mol)
Dựa vào công thức contact giữa cân nặng và số mol: M = m/n
Dựa vào tỉ khối (Áp dụng với các chất khí): dA/B = MA/MB; dA/kk= MA/Mkk=MA/29
Bước 2: Lập phương pháp phân tử của hợp hóa học hữu cơDựa vào phần trăm trọng lượng của những nguyên tố: %mC/12 = %mH/1 = %mO/16
Dựa vào công thức dễ dàng và đơn giản nhất: Kí hiệu công thức phân tử (CTPT), công thức đơn giản và dễ dàng nhất = CTĐGN
CTPT = (CTĐGN)n
2. Tìm phương pháp phân tử bằng phản ứng cháy của hợp hóa học hữu cơBước 1:Lập công thức bao quát của hợp chất hữu cơ: CxHyOz
Bước 2:Chuyển đổi những đại lượng đầu bài bác cho thành số mol.
Bước 3: Viết phương trình tổng quát của làm phản ứng cháy:
(1)
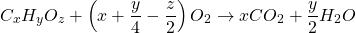
Bước 4:Thiết lập tỉ trọng số mol những nguyên tố trong công thức
Tìm trọng lượng mỗi nguyên tố
(2)
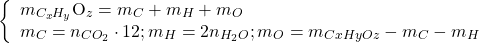
TH1: mCxHyOz= mC+ mH=> mO= 0, trong côn thức phân tửu chỉ bao gồm C với H (hidrocabon)
TH2: mO> 0, trong bí quyết phân tử bao gồm cả C, H, O
Tìm số mol nguyên tử của từng nguyên tố, tùy chỉnh cấu hình tỉ lệ số mol
(3)
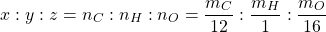
Bước 5:Biện luận CTPT của hợp hóa học hữu cơ: M = (CxHyOz)n => n, M
Chương 5. Dẫn xuất của hidrocacbon – Polime
Độ rượu
Khái niệm:Độ rượu được có mang là số mol etylic gồm trong 100 ml tất cả hổn hợp rượu cùng với nước.
Công thức tính độ rượu:

Công thức tính trọng lượng riêng
D = m/V (g/ml)
Bài tập vận dụng
Câu 1:Cho 23 gam rượu etylic nguyên chất tính năng với natri dư. Thể tích khí H2thoát ra (đktc) là bao nhiêu?
Câu 2: Cho 23 gam rượu etylic nguyên chất tác dụng với natri dư. Thể tích khí H2 thoát ra (đktc) là bao nhiêu?
Câu 3:Cho 11,2 lít khí etilen (đktc) chức năng với nước tất cả axit sunfuric (H2SO4) có tác dụng xúc tác, thu được 9,2 gam rượu etylic. Hiệu suất phản ứng là bao nhiêu?
Câu 4:Cần từng nào thể tích rượu nguyên chất cho vào 60 ml dung dịch rượu 40othành rượu 60o?
Câu 5.Khí CO2sinh ra khi lên men rượu một lượng glucozơ được đem vào dung dịch Ca(OH)2dư tạo ra 40 gam kết tủa. Khối lượng ancol etylic thu được là
Câu 6.Hòa tan 23,8 g muối M2CO3và RCO3vào HCl thấy bay ra 0,2 mol khí. Cô cạn dung dịch thu được bao nhiêu gam muối bột khan.
Câu 7.Cho 20,15 gam tất cả hổn hợp 2 axit no solo chức chức năng vừa đủ với hỗn hợp Na2CO3thì thu được V lít khí CO2(đktc) cùng dung dịch muối. Cô cạn dung dịch thì chiếm được 28,96 gam muối. Quý giá của V là?
Câu 8.Đốt cháy hoàn toàn m gam hợp chất hữu cơ A yêu cầu dùng 11,2 gam khí oxi, nhận được 8,8 gam CO2và 5,4 gam H2O. Ở đktc 2,24 lít khí A có khối lượng 3 gam. Xác định CTPT của A?
Câu 9:X mạch hở gồm công thức C3Hy. Một bình bao gồm dung tích không đổi chứa các thành phần hỗn hợp khí X với O2 dư ở 150ºC, áp suất 2 atm. Nhảy tia lửa điện để đốt cháy X tiếp đến đưa bình về 150ºC, áp suất vẫn là 2 atm. Bí quyết phân tử của X?
Câu 10: Khi đốt cháy trọn vẹn 15 mg hóa học A chỉ nhận được khí CO2 và tương đối nước, tổng thể và toàn diện tích của chúng quy về đktc là 22,4 ml. CTĐGN của A?
21 công thức hóa học lớp 9 đề nghị nhớ


Các định lao lý bảo toàn hóa học lớp 9
Định qui định bảo toàn khối lượngNội dung định biện pháp được phạt biểu ví dụ như sau: “ trong một bội nghịch ứng hóa học, tổng cân nặng của các thành phầm bằng tổng khối lượng của những chất phản ứng”.
Tổng khối lượng các hóa học tham gia = Tổng khối lượng các chất sản phẩm
Điều những con cần lưu ý ở đây chính là: sau làm phản ứng xảy ra, nếu gồm tạo khí tốt kết tủa thì nên trừ cân nặng các chất đó ra.
Ví dụ:Natri + Nước sinh sản thành Natrihidroxit cùng khí Hidro
Theo định biện pháp bảo toàn ta có: m(natri) + m(nước) = m(natrihidroxit) – m(hidro)
Bài tập về định luật bảo toàn khối lượng:
Bài 1: Đốt cháy trọn vẹn 9 gam sắt kẽm kim loại magie (Mg) trong không gian thu được 15 g các thành phần hỗn hợp chất magieoxit (MgO). Biết rằng sắt kẽm kim loại magie cháy là xảy ra phản ứng cùng với oxi trong không khí cùng phản ứng xẩy ra hoàn toàn.
a. Viết làm phản ứng hóa học trên.
b. Viết công thức về cân nặng của phản nghịch ứng xảy ra.
c. Tính cân nặng của khí oxi bội phản ứng.
Bài 2: Đốt cháy m(g) cacbon yêu cầu 16 g oxi thì nhận được 22 gam khí cacbonic. Tính m
Định qui định bảo toàn eletronTrong bội nghịch ứng oxi hoá – khử, số mol electron mà hóa học khử cho thông qua số mol electron mà chất oxi hoá nhận.
∑ne đến = ∑ne nhận
Định lý lẽ này thường xuyên được dùng làm giải các bài toán hóa nâng cấp hóa lớp 9. Nếu các con tất cả tham gia nhóm tuyển thi học tập sinh giỏi hóa những con cần được nắm định mức sử dụng này.
Xem thêm: Phụ Kiện Lắp Bồn Nước Inox Đứng, Phụ Kiện Bồn Nước
Bài tập trắc nhiệm áp dụng hóa học tập 9
Câu 1. Để trung hòa trọn vẹn 11,2gam KOH 20%, tín đồ ta vẫn cần từng nào gam hỗn hợp axit H2SO435%
a. 9gam
b. 4,6gam
c. 5,6gam
d. 1,7gam
Câu 2. Đầu tiên tổng hợp 23,5 gam K2O vào nước. Kế tiếp dùng 250ml hỗn hợp HCl để trung hòa - nhân chính dung dịch trên. Tính mật độ mol HCl cần.
a. 1,5M
b. 2,0 M
c. 2,5 M
d. 3,0 M.
Câu 3. Biết rằng trong hợp hóa học của lưu giữ huỳnh các chất lưu huỳnh chiếm 50% . Vừa lòng chất bao gồm công thức là:
a.SO3
b. H2SO4
c. CuS.
d. SO2 .
Câu 4. Đốt hoàn toàn 6,72 gam than trong không khí. Thể tích teo 2 thu được sống đktc là :
a. 12,445 lít
b. 125,44 lít
c. 12,544 lít
d. 12,454 lít.
Câu 5: trong những oxit sau. Hồ hết oxit nào chức năng được với dung dịch bazơ?
a.CaO, CO2Fe2O3.
b. K2O, Fe2O3, CaO
c. K2O, SO3, CaO
d. CO2 , P2O5 , SO2
Câu 6: Khí lưu huỳnh đioxit SO 2 tạo ra thành từ các chất nào mặt dưới? Chọn lời giải đúng?
a. K2SO4và HCl.
b. K2SO4và NaCl.
Na2SO4và CuCl2
d.Na2SO3và H2SO4
Câu 7: hòa hợp 2,4gam oxit của sắt kẽm kim loại hoá trị II vào 21,9gam dung dịch HCl 10% thì vừa đủ. Oxit sẽ là oxit như thế nào sau đây:
a. CuO
b. CaO
c. MgO
d. FeO
Câu 8: Để chiếm được 5,6 tấn vôi sống với công suất đạt 95% thì tín đồ ta cần bao nhiêu lượng CaCO3
a. 10 tấn
b. 9,5 tấn
c. 10,526 tấn
d. 111,11 tấn .
Câu 9: Hòa tan trọn vẹn 1,44g sắt kẽm kim loại hóa trị II bởi 250ml hỗn hợp H2SO40,3M. Để th-nc lượng axit dư cần dùng 60ml hỗn hợp NaOH 0,5M. Đó là sắt kẽm kim loại gì ?
A. Ca
b. Mg
c. Zn
d. Ba.
Câu 10.Đốt cháy 48 gam sulfur với khí oxi, sau phản nghịch ứng nhận được 96 gam khí Sunfuro. Trọng lượng của oxi tính năng là:
A. 40g
B. 44g
C. 48g
D.52g
Câu 11: Một oxit của kim loại R (hoá trị II ). Trong các số ấy kim một số loại R chiếm 71,43% theokhối lượng. Cách làm của oxit là:
A. FeO
B. MgO
C. CaO
D. ZnO
Câu 12: Để hòa tan hoàn toàn 1,3g kẽm thì nên 14,7g hỗn hợp H2SO420%. Khi phản ứng kết thúc cân nặng hiđro chiếm được là:
A. 0,03g
B. 0,04g
C. 0,05g
D. 0,06g
Câu 13: hòa tan 5 gam một sắt kẽm kim loại R (chưa rõ hóa trị ) đề nghị vừa đủ 36,5 gam hỗn hợp HCl 25%. Sắt kẽm kim loại R là:
A. Mg
B. Fe
C. Ca
D. Zn
Câu 14: mang lại 10,5 gam tất cả hổn hợp hai kim loại Zn, Cu vào dung dịch H2SO4loãng dư, thu được 2,24 lít khí(đktc). Phần trăm theo khối lượng mỗi kim loại trong láo hợp thuở đầu là:
A. 61,9% cùng 38,1%
B. 1/2 và 50%
40% cùng 60%
D. 30% và70%
Câu 15: Hòa tan trọn vẹn 7,8 gam một kim loại hóa trị I vào nước được một hỗn hợp bazơ X cùng 2,24 lít H2(đktc). Tên kim loại hóa trị I là:
A. Natri.
B. Bạc.
C. Đồng.
D. Kali.
Công thức hoá 9 tính tăng giảm khối lượng
Khối lượng bình tăng bằng trọng lượng chất phản nghịch ứng tính theo công thứcmbình tăng= mCO2+ mH2O
Khối lượng dung dịch bớt bằng cân nặng kết tủa trừ đi cân nặng bình tăng theo công thứcmdd giảm= mkết tủa–mbình tăng
Khối lượng hỗn hợp tăng bằng trọng lượng bình tăng trừ trọng lượng kết tủa theo công thứcMdd tăng= mbình tăng– mkết tủa
Trường hợp không tồn tại nước tham gia phản ứng thì cân nặng cacbon dioxit tính theo công thứcmCO2= mkết tủa– mdd giảmdạng
m = n.M trong những số ấy m là trọng lượng chất bắt buộc tìm, n là số mol, M phân tử khối
Công thức tính tỉ khối của nhị chất bởi ở cùng điều kiệndA/B=MA/MB= mA/mB
Công thức tính cân nặng riêngD = m/V trong số ấy m là trọng lượng của dung dịch, V là thể tích của hỗn hợp ở điều kiện tiêu chuẩn.
Các dạng bài tập tương quan công thức hóa 9
Các dạng bài tập tương quan đến bí quyết hoá 9 gồm các bài tập hỏi về khối lượng, thể tích nồng độ mol, giải pháp viết phương trình phản nghịch ứng hóa học của những chất khi tác dụng với axit bazơ kim loại…
Để giải quyết được những dạng bài xích tập này bạn cần nắm vững kim chỉ nan liên quan cho kim loại đặc điểm hóa học tập của oxit axit, oxit bazơ, tính chất của những muối kết tủa…Sau đó áp dụng những công thức tính khối lượng thể tích mật độ mol … nhằm giải những việc theo yêu cầu của đề bài ra. Cạnh bên đó bạn cũng có thể áp dụng những định hiện tượng bảo toàn cân nặng hay định biện pháp bảo toàn electron để xử lý bài tập dễ dàng hơn.
Bài tập 1: Đốt cháy hoàn toàn 11,2 lít khí metan. Hãy tính thể tích khí oxi đề xuất dùng với thể tích khí cacbonic chế tạo ra thành. Biết những thể tích khí đo ở đk tiêu chuẩn
Hướng dẫn giải:
Phương trình hóa học: CH4+ 2O2-> CO2+ 2H2O (1)
Áp dụngcác bí quyết hóa học tập lớp 9 nên nhớvề tính số mol của hóa học khí tại điều kiện tiêu chuẩn, ta bao gồm n (metan) = 11,2: 22,4 = 0,5 (mol)
Từ phương trình hóa học số (1) ta gồm số mol Oxi cần dùng bằng 2 lần số mol metan => nhằm đốt cháy hoàn toàn ta bắt buộc 1 mol oxi -> ta bắt buộc 22,4 (lít) khí Oxi
Cũng từ phương trình chất hóa học số (1) ta bao gồm số mol cacbonic sinh ra ngay số mol metan => thể tích khí cacbonic là 11,2 (lít)
Bài tập 2: Để đốt cháy 4,48 lít khí etilen rất cần được dùng
a) từng nào lít oxib) từng nào lít ko khí cất 20% thể tích oxiBiết thể tích những khí đo ở đk tiêu chuẩn
Hướng dẫn giải:
Phương trình hóa học: C2H4+ 3O2-> 2CO2+ 2H2O (1)
Áp dụngcác công thức hóa học tập lớp 9 nên nhớvề số mol của hóa học khí tại đk tiêu chuẩn, ta bao gồm n (etilen) = 4,48 : 22,4 = 0,2 (mol)










